尾气分析用于监控毕赤酵母发酵过程
毕赤酵母表达系统是最近十多年发展起来的真核表达体系,也是目前最为成功的外源蛋白表达系统之一,与其它现有的表达系统相比,毕赤酵母在表达产物的加工、产物分秘泌到胞外、翻译后修饰以及糖基化修饰等方面有明显的优势,现已广泛用于外源蛋白的表达。其中一类是甲醇诱导型毕赤酵母表达系统,这类表达系统可以以工业甲醇作为唯一的碳源,以氨水作为唯一氮源进行外源蛋白的表达。
毕赤酵母发酵过程属于高耗氧发酵,由于发酵过程菌体密度非常高,OUR最高可以达到150-200mmol/L/h。OUR和CER的大小表征着菌体代谢强度的高低,跟菌体生长,底物消耗速率,产物生成速率密切相关,而且对于高耗氧的发酵过程,通气和机械搅拌会消耗大量能源,同时发酵过程中往往伴随着大量的发加热,需要大量的冷却水。由于溶解氧浓度是供氧和耗氧共同作用的结果,仅从溶解氧变化趋势上,既不能反映出微生物代谢强度的变化也不能反映出设备供氧能力的优劣。当发酵液在这种高耗氧状态下,传统的溶氧电极读数几乎接近零点,溶氧监控几乎已经没有了指导意义。
在传统的甲醇诱导型毕赤酵母的发酵工艺控制中,甲醇补料速率控制是十分关键的。甲醇作为诱导阶段唯一碳源,过量和不足都会导致目标产物的表达异常。甲醇补料速率过低会使得菌体代谢受到限制,外源蛋白表达速率下降。甲醇补料速率过大会使得耗氧速率变大,溶解氧降低,伴随的是大量副产物例如有机酸生成。过量的甲醇往往会使得毕赤酵母中毒死亡,然而这个过程的表现与甲醇补料不足十分相似,经验不足的情况下往往会判断错误。一旦判断错误往往会做出加剧中毒的操作,从而造成无可挽回的经济损失。
本研究中通过过程质谱仪和电子鼻对毕赤酵母发酵过程中产生的尾气进行在线的监控,从而计算出发酵液中甲醇浓度的变化以及OUR的变化,并根据这些变化对甲醇的补加速率进行相应的调整。
甲醇的结构式为CH3OH,分子量为32经过电离源后特征碎片m/z为31,在m/z为32处相对离子强度约为31处的65%,同时氧气也会有极其少量的m/z为31的碎片产生。虽然氧气在m/z为31的离子强度非常低,但是相对尾气中非常低的甲醇的浓度电离出m/z为31的离子强度还是不能忽略的,相反的,甲醇虽然在m/z为32,也就是氧气的特征峰处碎片强度相当于特征峰处的65%,但是其浓度非常低,不会对氧气浓度测定产生太大的影响。另一个比较难以克服的问题是,目前所能拿到的甲醇标准气体(氩气作为平衡气)都会混有极少量的空气,这些极少量的空气中的氧气就会使得甲醇的碎片标定变得异常困难,使得标定数值会远远大于实际值。为了确定过程质谱仪是否对发酵液中甲醇浓度有很好的线性响应,我们在50L反应器中配置不同浓度的甲醇水溶液,保持一定的温度和空气流量,检测尾气质谱m/z31处离子电流对经过不同浓度的甲醇水溶液后空气的响应情况。图 5.1中可以看出,过程质谱仪m/z为31处的离子电流强度与甲醇水溶液中甲醇的浓度是线性相关的,由于空气中氧气也有极少量的m/z为31的碎片产生,所以,这条拟合出来的直线不会经过原点。
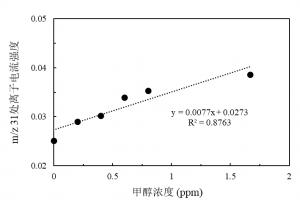
图1. 过程质谱对甲醇的响应
毕赤酵母发酵过程监控(生长期)
在毕赤酵母发酵过程中,能被电子鼻灵敏监控到的物质多为醇类和有机酸类。有机酸多在溶氧较低时开始积累,在主要碳源消耗殆尽后开始消耗这些积累的有机酸。电子鼻对醇类的灵敏程度远高于对有机酸的灵敏度,因此,当开始甲醇诱导后,电子鼻对甲醇的响应就掩盖了对有机酸的响应。图 5.2是采用电子鼻对毕赤酵母表达过程进行监控的曲线,图示阶段为甘油作为碳源,接种后随着菌体的生长OUR开始变大,溶解氧开始下降,下降到设定下限后开始采用溶氧转速联动控制溶氧。在12小时处,溶氧到达低点,此时电子鼻对过程尾气开始有响应,并且一直在变大直到基础料中甘油被耗尽,溶解氧快速回升,电子鼻对尾气的响应值开始迅速下降。再次流加甘油后溶氧迅速下降,OUR回升,一段时间后电子鼻的响应值有一次开始变大。在诱导前停止甘油流加后,这一现象再一次出现。另一个重要的生理代谢参数RQ的变化也证实了这一点。毕赤酵母以甘油作为唯一碳源生产时,RQ一般在0.6-0.7左右,菌体再次利用由于碳源不完全氧化而生成的有机物时,RQ一般会高于这种碳源完全氧化时的RQ。在每一次甘油耗尽、OUR下降、溶氧迅速上升时,RQ会由原来的0.6-0.7上升到1.0左右。
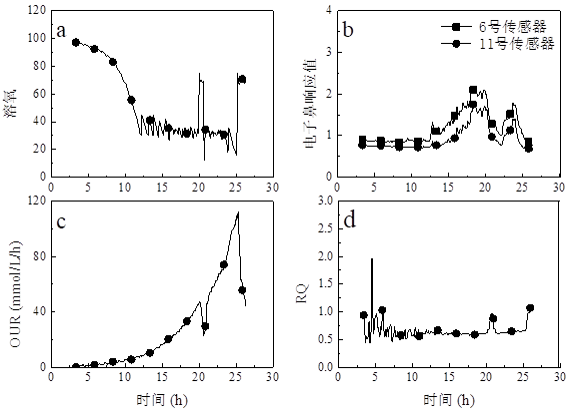
图2. 电子鼻监控毕赤酵母表达过程
在甲醇诱导型毕赤酵母表达过程中,为了使酵母细胞快速的由生长阶段转换到诱导阶段,其中一种常见的方法就是甘油补料停止后继续等待一段时间直到培养基残余的碳源全部消耗。传统工艺是以溶氧快速回升到70%以上后继续碳源饥饿半小时以上,没有从反应器内实际碳源消耗情况来确定诱导开始时间。采用过程质谱仪和电子鼻对毕赤酵母表达过程进行监控后,我们可以直接根据发酵液中碳源浓度或者实际发酵液中菌体耗氧速率来确定诱导的开始时间。
毕赤酵母发酵过程监控(诱导期)
毕赤酵母进入诱导期以后,甲醇的补料速率和甲醇的残余量控制是十分关键的。从理论上来说,我们可以建立一个模型,根据菌体浓度、菌体耗氧情况以及设备供氧情况等多个参数来计算出合适的补料速率。但是,仅仅靠模型建立的前馈控制是十分不可靠的,并且由于酵母菌体甲醇中毒的症状与补料不足症状有一些相似之处,根据模型建立的前馈控制有可能向着相反的方向进行。所以,我们要根据我们能够获取的数据建立反馈控制的方法。
图 3中,红色箭头为开始加入甲醇的时间点,可以看到溶氧开始下降的时候,电子鼻大部分通道立即开始有了强烈的响应(图3a),少数几个通道几乎达到最大响应10,甲醇开始为匀速流加。随着酵母菌体消耗甲醇速率的加快,OUR上升导致溶解氧开始下降(图 3b),与此同时,在此前积累的少量甲醇被消耗导致甲醇残余浓度下降,电子鼻的响应也同时开始下降。当下降到一定浓度后进入碳源限制状态后,甲醇的残余浓度下降开始变缓,同时溶氧开始回升。增加甲醇的补加速率后,相同的现象再次出现,当观察到甲醇浓度再次下降后,又及时的增加了甲醇的补料速率,在45-46小时左右有仍然有一个短暂的溶氧回升趋势的出现。每一次增加甲醇的补料速率后,OUR都会变得更高,溶氧会进一步下降。但是,在这种甲醇浓度下,过程质谱几乎没有有规律的响应。
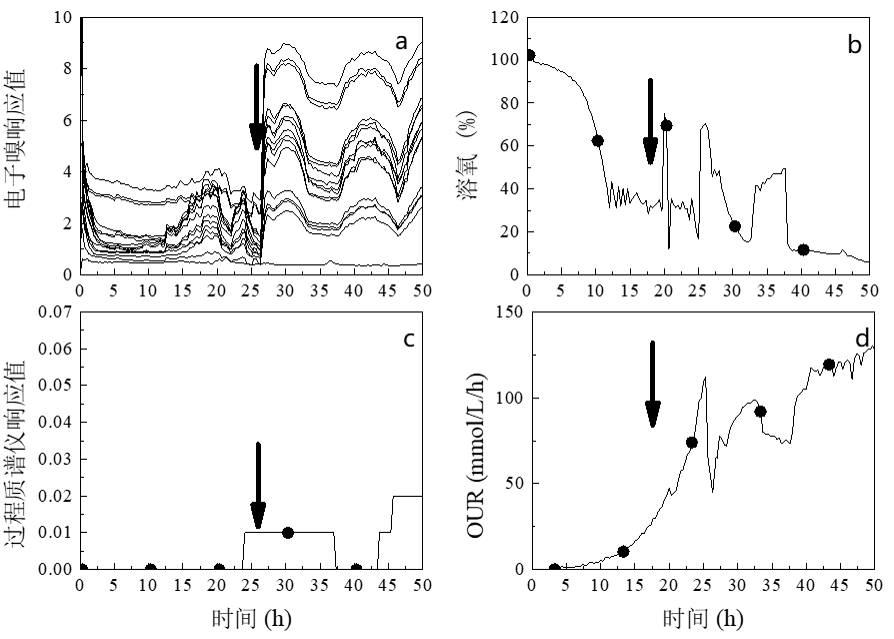
图3. 诱导初期电子鼻、溶氧和质谱对甲醇的响应
随着酵母菌体对甲醇利用的增加,甲醇的补料速率随之加快,进而甲醇的残余浓度开始上升。图 5.4中显示了整个过程中过程质谱仪和电子鼻监控到的数据,可以发现两者在60小时以后甲醇残余浓度达到比较高的值以后就具有非常好的对应关系。通过两台仪器获取的数据进行线性拟合(图 5.5)发现,两者的线性相关系数都达到了90%以上。有一个值得注意的问题就是,电子鼻的响应与甲醇浓度并不成线性关系,除非是在甲醇浓度非常低或者接近最大响应时会近似呈线性关系的,而过程质谱仪的数据是与甲醇浓度呈线性关系的。因此,我们可以合理的做出推测,电子鼻对甲醇响应远远比质谱对甲醇的灵敏度高,但是检测范围却小得多,在质谱仪开始对甲醇能够做出响应时,电子鼻已经几乎达到检测上限。

图4. 毕赤酵母全过程尾气数据

图 5. 电子鼻响应和过程质谱响应线性拟合
为了观察毕赤酵母甲醇中毒的过程,我们用正常甲醇补料速率4倍的速率补加甲醇(图6)。刚开始进入诱导阶段时,与预料的一样,由于甲醇的消耗pH下降(图 6a,pH设置为5)、OUR快速升高(图 6c)、溶氧下降(图 6b),过程质谱仪和电子鼻对甲醇的响应信号变大(图 6d、图 6e)。随着甲醇浓度的增加,酵母菌体开始进入轻微中毒状态,pH出现回升,OUR开始下降随之溶氧比较慢的上升(与碳源耗竭相比)。发酵41小时后停止甲醇流加,又经过5个小时左右,甲醇浓度逐渐的下降,酵母中毒状态逐渐解除,出现了与甲醇第一次开始流加类似的现象,pH下降,OUR上升溶解氧下降的现象。但是由于中毒过程是逐渐恢复,所以,OUR在停止甲醇补加后还继续下降了一段时间后不在变化,直到甲醇浓度下降到一定程度才开始上升。残余甲醇一直消耗到发酵55小时,残余的甲醇几乎耗尽,OUR快速下降进而溶解氧迅速回升。由于电子鼻对甲醇的响应是非线性的,并且检测上限非常低,所以,当甲醇浓度接近电子鼻的检测上限后就无法灵敏的反应出发酵液中甲醇的含量。过程质谱仪也监测到甲醇浓度的变化。
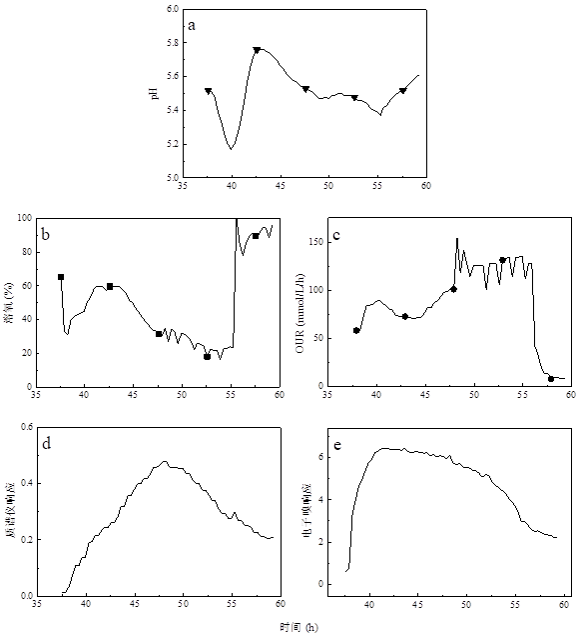
图6. 毕赤酵母甲醇中毒现象

